La mejor herramienta para la desmedicalización
GESTIÓN DE LA ALIMENTACIÓN APOYADA POR PLCs
Por M. Marco Laguna Product Manager de Cunicultura para España y Portugal, NANTA S.A.
Antibióticos y resistencias
Un poco de historia…
- Hace muchos años, la historia cuenta que algunas tribus euroasiáticas y sudamericanas sanaban heridas aplicando alimentos masticados y fermentados en las mismas.
- La Primera Guerra Mundial, horrible como todas las guerras, dio que pensar a muchos científicos, puesto que un gran número de vidas se perdían no por el traumatismo de las heridas sino por infección de las que aparentemente eran más leves o por causa de las necesarias amputaciones quirúrgicas.
- En 1928, Alexander Fleming -médico militar- vio cómo un cultivo de estafilococo no crecía en torno a una colonia de un hongo que de manera accidental había caído en la placa de cultivo. Este hongo era el Penicillium notatum y al metabolito descubierto se le llamó Penicilina.
- Años más tarde (1943) Albert Schatz encontró la Estreptomicina a partir del hongo Streptomyces griseus.
Podemos decir que un antibiótico es una sustancia química -producida por un ser vivo o sintéticacapaz de matar o impedir el crecimiento de algunos microorganismos (que llamaremos “sensibles”), en general bacterias. El antibiótico lesiona a la bacteria interfiriendo o dañando la integridad de la pared celular, bloqueando la síntesis de ácidos nucleicos (ADN, ARN) o inhibiendo la actividad de los ribosomas bacterianos -responsables de la síntesis proteica-.
Las bacterias comunes (animales y hombres) pueden transmitir la resistencia a antibióticos
Aunque sabemos sobradamente que estos mecanismos son muy efectivos, existe un gran inconveniente: hay bacterias que “aprenden” a evitarlos, y es más, se comunican con otras bacterias para enseñarles cómo. Esto es en dos líneas lo que denominamos fenómeno de resistencia bacteriana.
 La transmisión de resistencia de una bacteria a otra también puede darse interespecie -entre bacterias comunes a animales y hombre- y ser intermolecular -una bacteria resistente a un antibiótico, puede ser resistente a más, aunque nunca haya estado en contacto-.
La transmisión de resistencia de una bacteria a otra también puede darse interespecie -entre bacterias comunes a animales y hombre- y ser intermolecular -una bacteria resistente a un antibiótico, puede ser resistente a más, aunque nunca haya estado en contacto-.
El resultado de todo esto es un problema muy serio: cuanto más frecuentemente usemos antibióticos -en animales y hombre- menos eficaces serán.
El 5 de marzo de 2014, reconociendo ya la altísima sensibilidad europea por el tema de resistencias a los antimicrobianos de los microorganismos (RAM), se adopta el “Plan estratégico de acción para reducir el riesgo de selección y diseminación de resistencias a los antibióticos” que impactará de lleno en la totalidad de la producción ganadera en los años próximos.
- www.aemps.gob.es
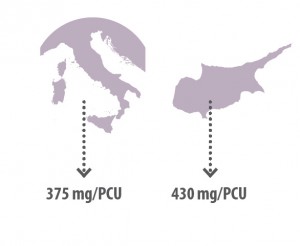 En los datos previos, España no sale muy bien parada con un consumo de 250 mg/PCU en 2011. Es decir, 250 mg de antibiótico totales por unidad de peso ganadero normalizada (Population Correction Unit).
En los datos previos, España no sale muy bien parada con un consumo de 250 mg/PCU en 2011. Es decir, 250 mg de antibiótico totales por unidad de peso ganadero normalizada (Population Correction Unit).
Una medida objetiva que sólo superan Italia y Chipre con 375 y 430 mg respectivamente ubicándose la media de 25 países en 115 (“Sales of veterinary antimicrobial agents in 25 EU/EEA countries in 2011”. Third ESVAC report).
En el informe orininal, también se estima que 25.000 muertes anuales en la UE son debidas a bacterias multirresistentes acarreando a su vez unos costes sanitarios extra de más de 1.500 millones de euros por cuidados hospitalarios.
No obstante, a nuestro favor se hace hincapié (y cito literal) en que “…la salud animal es fundamental para la obtención de alimentos sanos y seguros para consumo humano. Sin antibióticos eficaces para el tratamiento de las infecciones en animales, está en riesgo la obtención de estos alimentos.”
Pero… ¿podemos producir más eficientemente y con menos antibióticos?…
La parte positiva de este fenómeno es la clara reversibilidad del mismo. Todos vemos a nivel práctico cómo cuando dejamos bastante tiempo de emplear un antimicrobiano, éste vuelve a funcionar mejor. Producir con un empleo más prudente de antimicrobianos es realmente el reto que deberemos afrontar de cara a la normativa 2017.
Dicho de otro modo, llegado este momento, nadie va a prohibir el uso de antibióticos en ganadería sino que deberemos de emplearlos, si cabe, con criterios técnicos y diagnósticos más rigurosos.
La Unión Europea acaba de publicar la “Guía para el empleo prudente de antibióticos en medicina veterinaria” (Official Journal of European Union 11.9.2015) donde específicamente se habla de conejos aconsejando pautas preventivas. Hace especial hincapié en la ventilación, la densidad animal, los cambios graduales de piensos, la limpieza y desinfección de locales y la cuarentena de los animales que vayan a entrar.
A mi modo de ver, en cunicultura y con el error que conlleva generalizar, tenemos mucho que hacer en bioseguridad y profilaxis así como en mejora ambiental y manejo. No vamos abordar estos aspectos ahora pero es bastante con fijarnos en nuestras “hermanas mayores” como la avicultura.
Desde NANTA y ya de modo más ceñido a la nutrición, los técnicos de conejos llevamos más de un año trabajando simultáneamente en tres frentes:
- Mejor empleo de las medicaciones
- Nuevos aditivos
- Gestión automatizada de la alimentación
Mejor empleo de las medicaciones
Nuestro objetivo es conocer con precisión qué cantidad de antibiótico es capaz de bloquear una determinada bacteria y qué cantidad del mismo llega a los tejidos diana a partir de lo que dosificamos vía oral.
Técnicamente esto es laborioso pero posible; ya ha pasado el tiempo de emplear “a ojo” las ppm en el pienso. El cálculo de MICs (Concentraciones Mínimas Inhibitorias) y el conocimiento de la farmacocinética de los antibióticos son imprescindibles para conseguir este objetivo. Con la ayuda de Lorenzo Fraile Sauce (Universidad de Lleida) y Gema Chacón (Laboratorios Exopol) hemos iniciado la vía para abordar procesos ligados a Pasteurella y Estafilococo con una mayor precisión.

Nuevos aditivos
Es un mundo prometedor. Requiere como todo una evaluación precisa para conocer la funcionalidad de cada aditivo y poder discriminar una “actividad constatada” de un “placebo”.
Flora, acidificantes, pro y prebióticos, inmunoestimulantes, inmunomoduladores, AG esenciales y todas combinaciones posibles merecen capítulos cada uno. De manera continuada en el Trow Nutrition PRC vamos testando los que teóricamente parecen de mayor interés para su eventual validación.
Gestión de la alimentación
En otras industrias y cómo no, en otras especies ganaderas, podemos trabajar en producción de una manera “predictiva”. Es decir, conociendo determinados parámetros y siendo capaces de modificarlos podemos alterar el resultado final. Sirva como ejemplo la energía del pienso y el índice de transformación en broilers en condiciones termoneutras.
En conejos cierto es, tomamos muchos datos pero ¿nos sirven realmente para pronosticar cosas?
¿Es predictivo de algo en número de inseminaciones?
¿La fertilidad, la fecundidad, los nacidos…?
¿Sabemos cuánto mejora nuestra conversión por cada 100 kcal/kg que incrementamos la energía digestible de la dieta?
Pequeño recuerdo fisiológico y bases
El conejo es un mamífero fermentativo cecal muy voraz. Con administración ad libitum el ciego está prácticamente lleno todo el tiempo.
 Desde la nutrición, han sido ampliamente estudiados mecanismos que regulan el tránsito digestivo (equilibrios de fibras, LAD ideal…).
Desde la nutrición, han sido ampliamente estudiados mecanismos que regulan el tránsito digestivo (equilibrios de fibras, LAD ideal…).
El ciego aloja gran cantidad de flora (más de 10E 12 bacterias por gramo de pared) que puede desequilibrarse con facilidad. Los cecotrofos, como sabemos, los verdaderos nutrientes del animal, aportan más del 20% de las necesidades proteicas totales, aminoácidos digestibles y vitaminas y ya en el intestino delgado, unas vellosidades sanas y funcionales nos asegurarán un mejor aprovechamiento de los nutrientes.
De media, un conejo de engorde solo emplea el 12% de su tiempo disponible en comer. Razonando así, con 3 ó 4 horas de administración de alimento deberían de tener bastante. Muy posiblemente sea desde Francia (Larour 2002 y Boisot 2003 entre otros) donde se inician estudios serios del racionamiento con interés en optimizar la ecuación: peso a la venta – conversión – mortalidad. Sabemos que con dietas más energéticas, siempre que no existan condicionantes térmicos, el conejo tiende a comer menos.
Dicho de otro modo, una restricción efectiva debe de ir orientada a energía y no a volumen o al peso del producto. Sólo un 37% de la energía suministrada diariamente se empleará en “producción”, el resto se consumirá en las funciones metabólicas intrínsecas del animal. Algunos autores (Jerome, 1998) definen restricciones limitando el tiempo de acceso al comedero; así 6, 8 ó 10h dan restricciones respectivamente del 37,2%, 26,1% y 19,6% sobre consumos ad libitum.
Sabemos que, dentro de los límites estudiados y sobre todo en la primera fase de cebo, restricciones crecientes dan caídas en mortalidad y morbilidad (digestivo) directamente proporcionales en periodos de engorde desde 35 a 54 días.
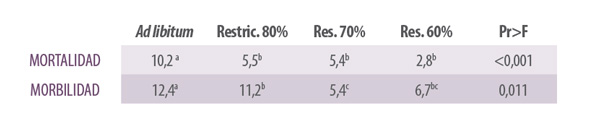
Tabla 1. Relación de mortalidad y morbilidad en función de distintos manejos alimentarios
Por otro lado, aunque podemos racionar igual en los modelos de 11 días postparto o S25, es lógico pensar que cuanto antes sea el destete, más fácil será optimizar los resultados con esta herramienta, puesto que tendremos más días para aplicar estrategias de crecimiento concretas.
- La restricción aumenta la digestibilidad de la dieta (Lebas, Szendro y otros) puesto que aumenta el tiempo de contacto del alimento con la pared cecal (flora digestiva) y posteriormente con el epitelio de absorción del intestino delgado.
- Además, el llenado y vaciado cíclico del tracto digestivo disminuye el riesgo de crecimiento de algunos patógenos como E. coli o clostridio.
Recientes estudios en el Nutreco PRC (R. Crespo y otros 2014) demuestran que el efecto que posee la restricción sobre el crecimiento es más severo en la primera fase de cebo (35 a 48 días) y más leve después, ello argumentaría el empleo de diferentes porcentajes de restricción dependiendo de la edad-peso de los animales.
En este trabajo también se observa una mejora del IC con respecto ad libitum sobre todo en esta fase.
En condiciones de termoneutralidad
- Las necesidades son variables dependiendo del peso vivo del animal y de su velocidad de crecimiento
- Hay que restringir por “energía diaria” no por peso del pienso
- El nivel de restricción es variable dependiendo del momento de cebo y del riesgo sanitario
 ¿Y para empezar?
¿Y para empezar?
Previamente al trabajo con PLCs es interesante realizar un chequeo de estatus general de explotación para establecer el “punto de partida”. Existen herramientas a propósito para ello.
UNA VEZ INSTALADO EL PLC DEBEREMOS DEFINIRLE:
- Los piensos que vamos a emplear en nuestra granja con sus aportes energéticos.
- Los animales que tenemos en cada jaula de cebo y la cabida (peso) de comedero en cada una.
- “Iniciaremos la nave” estableciendo la edad de los animales y la línea de referencia.
- Definimos la hora de comenzar el reparto.
- Comprobaremos (opciones más avanzadas) la curva con la que trabaja el PLC o establecemos un modelo propio.
¿Cómo articulamos una pauta de restricción ideal?
“Racionar” es sencillo y existen varias técnicas (restringiendo agua, con temporizadores de reparto, por tablas…) pero el único modo de emplear esta herramienta de manera eficiente es mediante el empleo de PLCs.
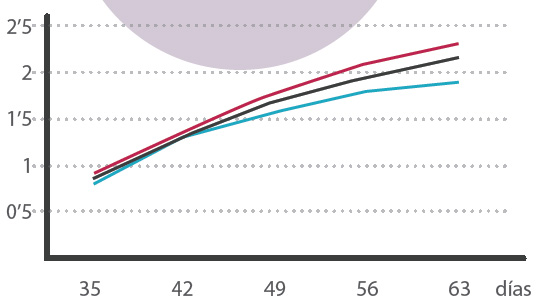
Gráfico 1. Curvas patrón de crecimiento en engorde
Esta curvas “patrón” ofrecen máximos (línea roja) y mínimos (azul); la “estrategia”(negra) de crecimientos que decidamos llevar en nuestra granja será particular en cada caso.
 La secuencia de trabajo con el PLC en la explotación es siempre la misma y sencilla:
La secuencia de trabajo con el PLC en la explotación es siempre la misma y sencilla:
- El PLC dará órdenes a los sinfines para que administren el pienso necesario -siempre calculado en Energía Metabolizable- para obtener una velocidad de crecimiento conocida con mínimo riesgo de bajas por problemas digestivos.
- Comprobaremos de modo intermitente si esto se cumple y nuestros gazapos están creciendo como hemos programado -pesadas al menos semanales de como mínimo un 2% del engorde-.
- Corregiremos los parámetros si es necesario y que el autómata recalcule.
- Es muy importante consolidar todos los datos para llegar a conclusiones. Poder “predecir”.
Partiendo de unas curvas patrón de crecimiento en engorde que puede proporcionarlas la empresa de la genética, estableceremos nuestros objetivos de explotación, Gráfico 1
Algunos resultados
En realidad aunque ahora el tema de racionamiento es de máxima actualidad, tenemos explotaciones que llevan más de cuatro años trabajando con autómatas y los resultados son evidentes.
Mostramos dos ejemplos, nos fijaremos en mortalidades de cebo:
- Granja A Años 2012 a 2015 (proyectado) con gran impacto de mortalidad en 2013 por VHDv. Son cuatro módulos de más de 6.500 nacidos por banda
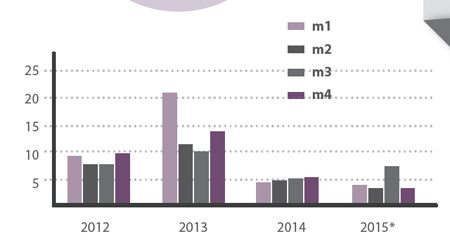
Gráfico 2. Ejemplo Granja A. Evolución de la mortalidad por VHDv en cebo rabajando con atuómatas de control
- Granja B Las mejoras en los engordes son evidentes con la utilización de autómatas de control
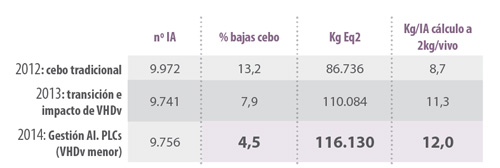
Tabla 1. Ejemplo Granja B: medias 2012 a 2014 consolidado. Pienso de retirada: 21 días
El pasado 5 de octubre una decena de países de la cuenca del Océano Pacífico -EEUU, Japón, Australia, Canadá, México, Perú, Singapur, Vietnam, etc.- han sellado el Acuerdo de Asociación Transpacífico -TPPque va a reducir las barreras comerciales afectando en un 40% aproximado la economía mundial incluyendo, cómo no, a todos los operadores de la cadena alimentaria.
¿Cómo afectará todo esto a la producción ganadera y a la desmedicalización?
Conclusiones
Los retos más importantes en nuestra explotación son reducir el porcentaje de bajas en engorde, mejorar el índice de conversión y estar preparados para la normativa 2017 en cuanto al empleo de medicaciones.
La Gestión de Alimentación mediante PLCs es herramienta indispensable para conseguir estos objetivos