Por Barragán, A. Muñoz-Silvestre, A. Pérez-Fuentes, S. Viana, D. Selva, l. Corpa J.M.
Instituto de Ciencias Biomédicas. Unidad de Histología y Anatomía Patológica. Facultad de Veterinaria. Universidad CEU Cardenal Herrera
La necropsia constituye una de las herramientas más importantes a la hora de llevar a cabo el diagnóstico de numerosas patologías. Además, nos aporta información que de otra forma sería difícil de conseguir.
La necropsia es rápida, económica y fundamental para seleccionar correctamente muestras a remitir al laboratorio para diferentes tipos de análisis: histopatológicos, microbiológicos, parasitológicos, toxicológicos, etc.
Antes de comenzar con la técnica, es necesario contar con la colaboración sincera del cunicultor. Debemos realizarle un detallado cuestionario (anamnesis) que nos aporte ocurriendo en la granja: signos clínicos, número y edades de animales afectados, fecha de aparición, número de animales muertos, cambios en la alimentación, introducción de nuevos animales, etc.
Para ello, es de gran utilidad tener previamente preparada una “hoja de necropsias” que nos permita recoger toda esta información, así como los hallazgos observados posteriormente, para luego registrarla y archivarla.
Si no podemos realizar la necropsia inmediatamente después de la muerte del animal debemos almacenar el cadáver refrigerado pero no congelado
MATERIAL DE NECROPSIAS
- Guantes desechables
- Bisturí
- Tijeras
- Pinzas
Para tomar muestras de tejidos y poder llevar a cabo estudios histopatológicos es recomendable llevar:
- Botella de formol tamponado al 10%
- Botes de plástico
- Rotulador
Para poder intercambiar información con los veterinarios es importante contar con:
- Una cámara de fotos (o un móvil con cámara) que nos permita registrar las lesiones observadas.
TÉCNICA DE NECROPSIAS
- Ordenada, siempre debe tener el mismo orden.
- Sistemática, los mismos principios.
- Completa, se tiene que analizar todo el cadáver de forma exhaustiva.
Esto último, en condiciones de campo, no siempre es sencillo.
LOCALIZACIÓN ANATÓMICA
Además de dominar la correcta ejecución de la técnica de necropsia es importante tener conocimientos de la localización anatómica y del aspecto normal de los diferentes órganos y estructuras corporales.
También es importante saber reconocer las lesiones macroscópicas asociadas a los principales procesos patológicos cunícolas.
LAS MUESTRAS
Para que las muestras estén en condiciones óptimas para su posterior estudio histopatológico, deben tomarse cuanto antes, evitándose así la autolisis de las mismas.
Por lo tanto, lo más recomendable, siempre que sea posible, es hacer la necropsia inmediatamente después de la muerte del animal. Si esto no fuera posible, el cadáver se debería mantener en refrigeración.
El almacenamiento del cadáver en congelación no es conveniente ya que durante la congelación y descongelación se forman micro-cristales de hielo en los tejidos que destruyen las células y las estructuras tisulares normales, lo que interfiere en el diagnóstico
LOS CADÁVERES
Para realizar una correcta necropsia es necesario contar con cadáveres frescos y, para que sea realmente útil, debe haber muerto del proceso que afecta a la mayor parte de animales. Lo aconsejable es sacrificar humanitariamente y necropsiar varios animales que muestren signos clínicos representativos.
Es fundamental reconocer las lesiones macroscópicas asociadas a los principales procesos patológicos
REGISTRO DEL CASO
Las necropsias deberían quedar registradas, de modo que lo más práctico es disponer de un libro o cuaderno donde apuntar todos los datos.
Además sería recomendable tener un necropsias realizadas.
En dichas fichas debería quedar anotado:
- Datos del animal
- Anamnesis
- Lesiones observadas en la necropsia
- Resultados de pruebas complementarias
INSPECCIÓN EXTERNA
Se examinará externamente al cadáver, diferenciando posibles cambios post-mortem (rigidez cadavérica o rigor mortis, lividez post-mortem o livor mortis, etc.) de lesiones reales.
Es importante observar la condición corporal del animal así como el estado de la piel y el pelaje, ya que muchas enfermedades afectan al estado nutricional del los animales y a la formación de pelo. También se revisarán las extremidades por si mostraran alteraciones.
Por último, se llevará a cabo una inspección busca de contenidos anormales (moco, pus, sangre, etc.) o coloraciones anómalas de las mucosas (Imagen 1).
ESTABILIZACIÓN Y RETIRADA DE PIEL
Realizaremos la necropsia situando al animal en decúbito supino o decúbito dorsal, es decir, con el cadáver “boca arriba”, ya que nos permitirá tener un campo de observación más amplio.
En primer lugar, se realizará un corte a nivel axilar para separar la escapula del tórax.
Esto nos permitirá estabilizar el animal en la posición deseada y reducir el tiempo de necropsia (Imagen 2).
Con el fin de retirar la piel realizaremos una incisión longitudinal por la línea alba (también llamada línea media) desde la mandíbula hasta el pubis (Imagen 3).
Separaremos la piel de la musculatura lateralmente.
A continuación se examinará el tejido subcutáneo, la grasa, los músculos, las glándulas mamarias y los nódulos linfáticos.
Éstos son muy importantes, ya que son indicadores de posibles procesos patológicos regionales o sistémicos.
APERTURA DE CAVIDADES
Comenzaremos abriendo la cavidad abdominal. Para ello justo donde termina la cavidad torácica (Imagen 4).
A continuación se seccionará la musculatura abdominal la línea alba, con cuidado de no perforar las vísceras abdominales.
Antes de seguir abriendo la cavidad abdominal es importante evaluar la existencia de contenidos anómalos en la misma (líquido seroso, sangre, pus,..).
Seguidamente se realizarán dos cortes laterales, paralelos al borde de las costillas, hasta dejar todas las vísceras abdominales a la vista (Imagen 5 e Imagen 6).
Tras abrir completamente la cavidad correcta posición de los órganos abdominales.
A continuación se abrirá la cavidad torácica.
Para ello se cortaran las costillas aproximadamente a nivel costocondral, a ambos lados del esternón.
Se levantará éste con cuidado de no desgarrar el pericardio.
Una vez retirado el esternón se evaluará la adecuada situación anatómica de las vísceras y la presencia de líquidos dentro de la cavidad (Imagen 7) pulmones y pericardio
Una vez examinadas ambas cavidades, se procederá a la evisceración de la cavidad abdominal. Primero se extraerá el aparato digestivo.
Para ello, se localizará el esófago y se cortará lo más craneal que se pueda para evitar el reflujo del contenido gástrico (Imagen 8).
A continuación se cortará caudalmente el recto.
Se retirará todo el paquete gastro-intestinal junto a páncreas y bazo, dejando en el cadáver el hígado, el aparato urinario, las glándulas adrenales y el aparato reproductor (Imagen 9) que se extraerán posteriormente
Debemos evaluar la adecuada situación de las vísceras y la presencia de líquidos
Para facilitar la extracción del final del aparato genitourinario se pueden seccionar los huesos pelvianos, cortando a ambos lados de la sínfisis pelviana (Imagen 10).
Finalmente se retirarán los riñones, uréteres y vejiga urinaria juntos, si es posible (Imagen 11 e Imagen 12)
EVISCERACIÓN DE VÍSCERAS TORÁCICAS Y DE LA REGIÓN DEL CUELLO
Con el fin de poder retirar la lengua se realizarán cortes paralelos a las dos ramas de la mandíbula en el espacio intermandibular.
Una vez cortada toda la musculatura se tirará de la lengua caudalmente hasta dejar a la vista la entrada de la laringe. A medida que se va cortando es conveniente revisar los nódulos linfáticos regionales.
Para retirar la tráquea se desarticularán los huesos hioides de ambos lados (Imagen 13 e Imagen 14).
A continuación se separará la tráquea y el esófago de la musculatura del cuello hasta la entrada de la cavidad torácica.
Por último, tirando de la lengua caudalmente, se desgarrará el mediastino que une los pulmones con el techo de la cavidad torácica, extrayendo los pulmones y el corazón de forma conjunta.
SEPARACIÓN DE CABEZA Y APERTURA
Para separar la cabeza hay que localizar la articulación atlanto-occipital cortando la musculatura adyacente y, a continuación, seccionar la médula espinal para separar la cabeza.
Antes de abrir la cavidad craneal retiraremos la piel y la musculatura que cubre el cráneo.
A continuación, con una sierra, se harán tres cortes formando un triángulo isósceles invertido (Imagen 15).
La base estará entre uno y dos centímetros por detrás de los ojos y el vértice, cerrando el triángulo a nivel del agujero magno, por encima de los cóndilos.
Se extraerá el hueso, dejando a la vista el encéfalo cubierto por las meninges.
Si sospechamos de procesos nerviosos debemos hacer un estudio exhaustivo del sistema nervioso central por medio de la apertura de la cavidad craneal
Se cortarán las meninges lo que permitirá la observación y extracción del encéfalo (Imagen 16).
Posteriormente se seccionará la cabeza longitudinalmente con una sierra para separarla en dos mitades iguales (Imagen 17).
De este modo se podrán examinar la cavidad nasal y los cornetes nasales (Imagen 18).
APERTURA DE ARTICULACIONES
Es conveniente examinar varias articulaciones: como la atlanto-occipital o la articulación coxofemoral (Imagen 19).
Dentro del protocolo de la necropsia reglada debemos abrir tambien la articulación femorotibiorotuliana (Imagen 20), tarsiana, carpiana, etc.
A su vez es de vital importancia considerar y valorar el estado de la superficie articular para poder descartar mediante su estudio la existencia de distintas alteraciones que pudieron afectar al animal necropsiado.
El líquido presente en las articulaciones que son examinadas durante la necropsia debería ser filante, brillante y trasparente (ligeramente ambarino), de forma que cualquier cambio en coloración o densidad debe ser registrado, tomándose muestras si fuera necesario.
EXAMEN DE VÍSCERAS Y TOMA DE MUESTRAS
El examen de las vísceras deberá ser exhaustivo y sería necesario que lo hiciera una persona cualificada.
Se examinará el aparato respiratorio, separando previamente el corazón de los pulmones.
A continuación se abrirán tanto el esófago (que habrá quedado junto a la tráquea) como la tráquea longitudinalmente, observando la presencia de diferentes contenidos (moco, pus, alimento, espuma, aspecto de la mucosa, etc.) (Imagen 21).
Se dará algunos cortes a los pulmones sobre todo si existiera algún cambio de coloración o consistencia.
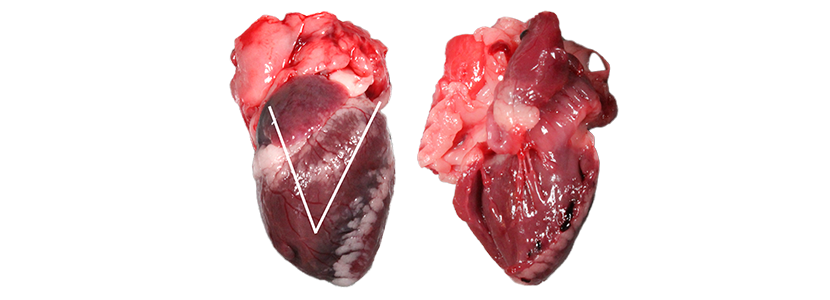
Para abrir el corazón se seguirá la dirección de la circulación sanguínea.
Primero abriremos el corazón derecho, realizando un corte en “V” desde la aurícula derecha hasta la parte más distal del ventrículo derecho, luego se subirá, paralelamente al tabique interventricular, hasta salir por la arteria pulmonar (Imagen 22).
Para abrir el corazón izquierdo se realizará un único corte desde la aurícula izquierda hasta el extremo o ápex del corazón.
Una vez abierto el corazón hay que evaluar el miocardio y el endocardio, en busca de presencia de anormalidades, haciendo hincapié en las válvulas cardiacas. Dichas válvulas deben ser lisas brillantes y trasparentes.
Continuaremos con las vísceras abdominales, empezando por el hígado (Imagen 23). Revisaremos su superficie y haremos varios cortes en ambas caras (visceral y diafragmática) para examinar el parénquima y abriremos la vesícula biliar.
Los riñones se cortarán longitudinalmente en dos partes iguales, para poder observar todas las capas renales (Imagen 24) y también se abrirá la vejiga urinaria para ver su contenido y el aspecto de la mucosa.
El tubo digestivo se valorará primero externamente, abriéndose posteriormente estomago por la curvatura mayor y diferentes tramos de intestino, haciendo hincapié en el ciego y del sacculus rotundus (Imagen 25). Se valorará tanto el contenido como las mucosas.
Es importante dejar algunas zonas de intestino sin abrir para tomar muestras en el caso de que fuera necesario.
Se tomaran muestras de todas las alteraciones visibles. Dichas muestras no deberán tener más de 2 cm de tamaño, para que el fijador penetre en los tejidos.
Las muestras se fijaran en formol tamponado al 10%, en una proporción de 1/10 es decir 10 volúmenes de formol por cada una volumen de tejido (Imagen 26).
El bote con las muestras deberá estar identificado, de forma indeleble y visible, con el número de registro.